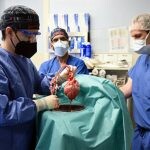
Tan solo unos días después de iniciar 2022, se alcanzó el que sin duda será uno de los mayores logros del año: trasplantar con éxito un corazón de cerdo a un hombre. La operación realizada por un equipo de cirujanos de la Universidad de Maryland (Estados Unidos) supone un hito para la medicina y un punto de inflexión para todos aquellos profesionales que llevan años desarrollando el campo del xenotrasplante y la biotecnología.
Uno de los referentes de este ámbito en España es Marc Güell, profesor del Departamento de Ciencias Experimentales y de la Salud de la Universitat Pompeu Fabra y fundador científico de eGenesis Bio. Esta empresa estadounidense trabaja para transformar el mundo de los trasplantes gracias a la ingeniería genómica y la edición genética. Hablamos con Marc Güell para conocer mejor el presente y el futuro de los trasplantes de órganos animales a humanos.
– ¿Cuántos años de investigación han sido necesarios para conseguir trasplantar un corazón de cerdo en un humano?
Son décadas de trabajo, se lleva avanzando en esto desde los años 90. Este logro tiene muchos pasos detrás, desde desarrollar las herramientas de ingeniería genética hasta estudiar qué cambios genéticos es necesario hacer en estos animales para hacerlos compatibles, pasando por el avance en el campo de los inmunosupresores. Creo realmente que es uno de los experimentos más complejos que se hacen en medicina.
– ¿Se trata de una acción aislada o esperáis que intervenciones como esta sean cada vez más habituales?
Creo que serán cada vez más habituales. Es un tipo de progreso muy portable: muchos de los avances que sirven para el corazón lo hacen también para el riñón y para islotes pancreáticos, por ejemplo. Las operaciones con algunos tejidos se han desarrollado lo suficiente como para aplicarse pronto a nivel clínico.
– ¿Cuáles son los retos que se presentan a continuación?
Hay muchas incógnitas a resolver. En primer lugar, hay que seguir muy de cerca estas primeras pruebas en humanos, para ver si se rechaza el órgano, cómo es su funcionalidad, etcétera.
Además, es importante seguir avanzando en el trasplante de otros órganos compatibles con humanos y acompañarlos de regímenes de inmunosupresión más precisos y seguros para el paciente. Hay consenso en que se ha avanzado mucho, pero nos gustaría avanzar más.
– ¿Cuáles podrían ser estos órganos compatibles?
Los que están más cerca son el riñón, el corazón y los islotes pancreáticos, y hay evidencias de la supervivencia de estos órganos durante varios años en primates no humanos. También se trabaja en otros órganos como el pulmón y el hígado, pero están a una distancia más grande de la aplicación clínica.
– Ya en 1960 se trasplantó un riñón de un chimpancé a un humano.
Sí, y realmente hay ilustraciones que demuestran que la gente probó a sustituir partes de humanos con otras de animales hace siglos. Supongo que esto es una solución muy intuitiva: si no funciona una parte de un humano, vamos a probar con la de un animal.
Estos experimentos fallaron porque no había herramientas para bajar el rechazo. Solo empezaron a funcionar en la década de los 2000, cuando se mejoró en las investigaciones. Ha habido dos técnicas muy útiles: la clonación y CRISPR, toda la revolución de la ingeniería genética. Son las dos piezas que hacen falta para hacer un cerdo transgénico.
“Ha habido dos técnicas muy útiles: la clonación y CRISPR, toda la revolución de la ingeniería genética”.
Esto ayudó a modificar los animales y hacerlos más compatibles. El cerdo del que se utilizó para este trasplante tenía 10 cambios genéticos, y esto solo es posible gracias a los avances de los últimos años.
– ¿Por qué se utilizan cerdos y no otros animales?
Respecto a esto hay un consenso importante. A nivel ético, es muy difícil hacer experimentos en primates no humanos. Tiene que estar muy justificado, especialmente en Europa. Después está el problema de la seguridad, que ha cobrado importancia con esta pandemia: cuanto más cercano es el animal al humano, más probable es que salten patógenos y se den casos de zoonosis. Tenemos el caso del sida, por ejemplo, que saltó de los primates a los humanos.
La tercera es una cuestión muy práctica. Tenemos mucha experiencia haciendo cosas con cerdos, tanto a nivel alimentario como biotecnológico. Esto ayuda a la hora de hacer cambios genéticos y programas de reproducción con estos animales. Por último, entra en juego también el tamaño de los órganos y la similitud entre ellos. Para el xenotrasplante se suelen usar algunas variedades de minicerdos o minipigs, que tienen tamaños de unos 70 kilogramos.

– Para utilizar los órganos de estos cerdos es necesario humanizarlos. ¿Cómo se consigue que sus órganos sean lo más compatibles posible con las personas?
Se hacen varios tipos de modificaciones. Algunas consisten en quitar genes que los cerdos tienen y nosotros no, como antígenos de superficie que generan muchos anticuerpos. También se añaden genes humanos para humanizar algunas cuestiones concretas. Por ejemplo, partes del sistema inmunitario, para evitar rechazos y mejorar la inmunidad, y proteínas de coagulación de la sangre, para mejorar su fluidez.
Además, se trabaja para eliminar los virus endógenos de los cerdos. Este es un tema importante porque estos virus de los cerdos son muy activos. Gracias a CRISPR, se pueden crear cerdos libres de estos virus, conocidos como PERVs.
– Al hacer un trasplante hoy en día, ¿se puede estar seguro de que no habrá una transmisión de virus?
Nunca podemos asegurarlo al 100 %, aunque con CRISPR sí se pueden eliminar estos virus en concreto. Sin embargo, esto no siempre se considera necesario y existe cierta división al respecto en el campo del xenotrasplante. En el caso del trasplante de corazón de cerdo a humano, la empresa que lo proporcionó, Revivicor, no había hecho esto.
– Si se presenta un futuro en el que este tipo de trasplantes conviven o incluso desplazan los de las personas, ¿qué medidas sería necesario tomar para respetar el bienestar animal?
Cualquier experimentación con animales está muy regulada, también en el caso de xenotrasplantes. Hay que pasar por muchos comités y trabajar en entornos muy controlados y transparentes para tratar de minimizar el sufrimiento animal. Tanto el de los cerdos que se utilizan como donantes como el de los primates no humanos que se usan para hacer las pruebas.
“Hablamos de salvar una vida, y la gran mayoría de humanismos y religiones consideran salvar la vida como el valor más importante”.
Cuando trabajaba en eGenesis Bio y en la Universidad de Harvard exploramos mucho este tema, hablando con personas de diferentes culturas y religiones. En este sentido, es una situación diferente a la de las cuestiones alimentarias. Hablamos de salvar una vida, y la gran mayoría de humanismos y religiones consideran salvar la vida como el valor más importante. Un porcentaje muy alto se sentía cómodo con la idea de utilizar un animal para salvar la vida de una persona.
– ¿Se presentó algún colectivo o sector de la sociedad en contra?
Este fue uno de los aspectos que me sorprendió más. Incluso personas de algunas religiones que no permiten consumir cerdo, no veían problema en utilizar un órgano si el objetivo final es salvar una vida. De hecho, hay partes del cerdo que se usan en medicina desde hace años, como las válvulas cardíacas y la piel.

– ¿Crees que el xenotrasplante puede ser una solución para suplir las carencias del modelo actual, basado en donaciones altruistas, a corto o medio plazo?
Poner fechas es difícil. Lo que está claro es que ha habido un avance enorme. Ahora mismo, xenotrasplantes de riñones o corazones duran años en primates no humanos con una función fisiológica muy buena. ¿Cuándo podremos dar el salto a la clínica 100 %? Solo el tiempo lo dirá. Pero es buena noticia que en solo dos meses hayamos visto un trasplante de corazón y otro de riñón. Estoy convencido de que va a haber buenas noticias durante los próximos años. Me sorprendería lo contrario.
“La situación en cuanto a los trasplantes solo puede a ir a peor, porque por suerte cada vez vivimos más, las unidades de cuidados intensivos son mejores y hay menos accidentes de tráfico”
Actualmente, España es líder del mundo de gestión de trasplantes y aun así hay unas listas de espera larguísimas. Esto solo puede ir a peor, porque por suerte cada vez vivimos más, las unidades de cuidados intensivos son mejores y hay menos accidentes de tráfico.
La única opción para reducir las listas de espera de forma significativa es optar por estas soluciones alternativas. Para corazón y riñón, el xenotrasplante es la opción que está más cerca de solucionar el problema. Para otros órganos, pueden usarse también soluciones como la impresión 3D o terapias basadas en células madre. Sin embargo, todavía estamos lejos de poder usarlas para trasplantar un corazón.
– Actualmente, en tu empresa Integra Therapeutics y en tu laboratorio de la Universitat Pompeu Fabra desarrolláis otros proyectos de biotecnología, ajenos al xenotrasplante. ¿En qué consisten?
Tenemos varias líneas de investigación. Por un lado, desarrollamos tecnologías para hacer gene writing. Es decir, escribimos en genomas con finalidades terapéuticas, para tratar tanto enfermedades genéticas como el cáncer.
Por el otro, hacemos bioingeniería con las bacterias que viven en nuestra piel. Añadimos circuitos genéticos con distintas funcionalidades, como regular la segregación de sebo o colocar sensores para ver distintos parámetros del paciente o el entorno. Esto lo hacemos pensando en el futuro, en smart therapeutics o incluso en conexión a wearables, para monitorizar la salud de las personas o el entorno.
– De nuevo, entra en juego CRISPR.
Efectivamente. Yo he trabajado mucho con CRISPR, fui coautor del primer paper que se redactó en 2013 y desde entonces lo he aplicado a numerosos ámbitos. Al xenotrasplante, a la terapia génica del genoma humano o al microbioma de la piel, por ejemplo.
– ¿De qué manera pueden estos métodos y la tecnología en general transformar el modo en que entendemos la medicina?
Creo que la pueden cambiar totalmente. La medicina ya ha cambiado mucho en esta última década, y todas estas aplicaciones inspiradas en la biología nos ayudan a ser mucho más eficientes. El objetivo es cumplir las promesas que se hicieron cuando secuenciamos el genoma humano: reescribirlo para hacer xenotrasplantes, corregir errores o diseñar terapias, por ejemplo.
Si hacemos un repaso de los avances que se han hecho durante los últimos meses, muchos de ellos están relacionados con la biología, empezando por las vacunas de la COVID-19 basadas en ARN. La medicina sigue haciendo química, pero cada vez hace más biología.
En Nobbot | Francis Mojica, microbiólogo: «Fue suerte dar con CRISPR. Cuando uno mira, a veces encuentra cosas»
Imágenes | Marc Güell, Unsplash/Piron Guillaume, Unsplash/Jonathan Cooper, Unsplash/Misael Moreno